Μεταβατική κατάσταση
Σε μια χημική αντίδραση, η μεταβατική κατάσταση είναι το σημείο όπου υπάρχει η μέγιστη τιμή ενέργειας. Η ενέργεια αυτή ονομάζεται ενέργεια ενεργοποίησης. Όταν δύο ή περισσότερα μόρια αναμιγνύονται, θα χτυπηθούν μεταξύ τους. Εάν χτυπήσουν με αρκετή ενέργεια ώστε να περάσουν από τη μεταβατική κατάσταση, θα αντιδράσουν και θα σχηματίσουν νέα μόρια. Στη μεταβατική κατάσταση σχηματίζονται νέοι δεσμοί, ενώ οι παλιοί διασπώνται. Σε μια γραφική παράσταση ή ένα σχέδιο, η μεταβατική κατάσταση σημειώνεται συχνά με το σύμβολο του διπλού στιλέτου ‡.
Είναι πολύ δύσκολο να μελετηθεί μια μεταβατική κατάσταση. Αυτό οφείλεται στο γεγονός ότι η ενέργεια είναι τόσο υψηλή που τα μόρια θα παραμείνουν σε αυτή τη μορφή για πολύ μικρό χρονικό διάστημα, συνήθως femtoseconds. Είναι σημαντικό να μην συγχέουμε τις μεταβατικές καταστάσεις με τις ενδιάμεσες καταστάσεις. Οι ενδιάμεσες καταστάσεις βρίσκονται σε ελάχιστα σημεία ενέργειας και μπορούν να ζήσουν για πολύ μεγάλο χρονικό διάστημα. Όπως και μια μεταβατική κατάσταση, ωστόσο, ένα ενδιάμεσο βρίσκεται μεταξύ αντιδραστηρίων και προϊόντων μιας αντίδρασης.
Η μελέτη των μεταβατικών καταστάσεων είναι πολύ σημαντική για την κατανόηση των μηχανισμών των αντιδράσεων. Υπάρχουν θεωρίες και προγράμματα υπολογιστών που μπορούν να χρησιμοποιηθούν για τον υπολογισμό του τρόπου με τον οποίο μοιάζει η κατάσταση μετάβασης. Αυτό αποτελεί μέρος της χημικής κινητικής.
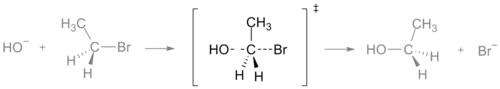
Η κατάσταση μετάβασης μιας αντίδρασης SN2
Ερωτήσεις και απαντήσεις
Ερ: Ποια είναι η μεταβατική κατάσταση σε μια χημική αντίδραση;
A: Η μεταβατική κατάσταση είναι το σημείο όπου υπάρχει μέγιστη τιμή ενέργειας σε μια χημική αντίδραση.
Ερ: Ποια είναι η ενέργεια ενεργοποίησης σε μια χημική αντίδραση;
A: Η ενέργεια που απαιτείται για να συμβεί μια αντίδραση ονομάζεται ενέργεια ενεργοποίησης.
Ερ: Τι συμβαίνει όταν δύο ή περισσότερα μόρια αναμιγνύονται σε μια χημική αντίδραση;
Α: Όταν δύο ή περισσότερα μόρια αναμιγνύονται, θα χτυπηθούν μεταξύ τους. Αν χτυπήσουν με αρκετή ενέργεια ώστε να περάσουν από τη μεταβατική κατάσταση, θα αντιδράσουν και θα σχηματίσουν νέα μόρια.
Ερ: Για ποιο λόγο χρησιμοποιείται το σύμβολο του διπλού στιλέτου (‡) σε ένα γράφημα ή σχέδιο μιας χημικής αντίδρασης;
Α: Το σύμβολο του διπλού στιλέτου (‡) χρησιμοποιείται για να σημειώσει τη μεταβατική κατάσταση σε ένα γράφημα ή σχέδιο μιας χημικής αντίδρασης.
Ερ: Γιατί είναι δύσκολη η μελέτη της μεταβατικής κατάστασης σε μια χημική αντίδραση;
Α: Είναι πολύ δύσκολο να μελετηθεί η μεταβατική κατάσταση σε μια χημική αντίδραση επειδή είναι τόσο υψηλή η ενέργεια που τα μόρια θα παραμείνουν σε αυτή τη μορφή για πολύ μικρό χρονικό διάστημα, συνήθως femtoseconds.
Ερ: Τι είναι ένα ενδιάμεσο προϊόν σε μια χημική αντίδραση;
Α: Ένα ενδιάμεσο είναι ένα μόριο που βρίσκεται σε ελάχιστα σημεία ενέργειας σε μια χημική αντίδραση και μπορεί να ζήσει για πολύ μεγάλο χρονικό διάστημα.
Ερ: Γιατί η μελέτη των μεταβατικών καταστάσεων είναι σημαντική για την κατανόηση των μηχανισμών των αντιδράσεων;
Α: Η μελέτη των μεταβατικών καταστάσεων είναι σημαντική για την κατανόηση των μηχανισμών των αντιδράσεων, διότι βοηθά στον προσδιορισμό του τρόπου με τον οποίο λαμβάνει χώρα μια αντίδραση και του τρόπου με τον οποίο μπορεί να ελεγχθεί ή να χειραγωγηθεί.
ψάχνω