Μόριο
Ένα μόριο είναι η μικρότερη ποσότητα μιας χημικής ουσίας που μπορεί να υπάρξει. Αν ένα μόριο χωριζόταν σε μικρότερα κομμάτια, θα ήταν μια διαφορετική ουσία.
Τα μόρια αποτελούνται από άτομα που είναι κολλημένα μεταξύ τους σε ένα συγκεκριμένο σχήμα ή μορφή. Δεν είναι εξίσου δυνατοί όλοι οι συνδυασμοί ατόμων- τα άτομα σχηματίζουν ορισμένα σχήματα κατά προτίμηση έναντι άλλων. Επίσης, έχουν διαφορετική σθένους. Για παράδειγμα, τα άτομα οξυγόνου έχουν πάντα δύο δεσμούς με άλλα άτομα, τα άτομα άνθρακα έχουν πάντα τέσσερις δεσμούς με άλλα άτομα και τα άτομα αζώτου έχουν πάντα τρεις δεσμούς με άλλα άτομα.
Στην κινητική θεωρία των αερίων, ο όρος μόριο χρησιμοποιείται συχνά για κάθε αέριο σωματίδιο ανεξάρτητα από τη σύστασή του. Σύμφωνα με αυτόν τον ορισμό, τα άτομα των ευγενών αερίων θεωρούνται μόρια καθώς στην πραγματικότητα είναι μονοατομικά μόρια.
Στα αέρια, όπως ο αέρας, τα μόρια απλά πετούν γύρω γύρω. Στα υγρά, όπως το νερό, τα μόρια είναι κολλημένα μεταξύ τους, αλλά εξακολουθούν να κινούνται. Στα στερεά, όπως η ζάχαρη, τα μόρια μπορούν μόνο να δονούνται. Στην τέταρτη κατάσταση της ύλης, γνωστή ως πλάσμα, τα άτομα είναι ιονισμένα και δεν μπορούν να σχηματίσουν μόρια.
Με έναν μοριακό τύπο, μπορείτε να γράψετε τους αριθμούς όλων των ατόμων σε ένα μόριο. Για παράδειγμα, ο μοριακός τύπος της γλυκόζης είναι C6H12O6. Αυτό σημαίνει ότι ένα μόριο γλυκόζης αποτελείται από έξι άτομα άνθρακα, δώδεκα άτομα υδρογόνου και έξι άτομα οξυγόνου.
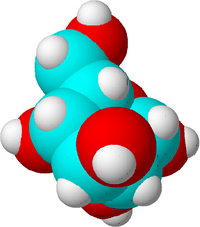
Πρόκειται για ένα μόριο ζάχαρης. Τα άτομα άνθρακα είναι μπλε, τα άτομα οξυγόνου είναι κόκκινα και τα άτομα υδρογόνου είναι λευκά για να φαίνεται η διαφορά. Στην πραγματικότητα τα άτομα δεν έχουν χρώμα.
Bonding
Για να υπάρξει ένα μόριο, τα άτομα πρέπει να κολλήσουν μεταξύ τους. Αυτό συμβαίνει όταν δύο άτομα μοιράζονται ηλεκτρόνια. Αντί να περιφέρεται γύρω από ένα μόνο άτομο, το ηλεκτρόνιο περιφέρεται τώρα γύρω από δύο. Αυτό ονομάζεται ομοιοπολικός δεσμός. Μερικές φορές, περισσότερα από ένα ηλεκτρόνια μοιράζονται. Όσο περισσότερα ηλεκτρόνια μοιράζονται, τόσο ισχυρότερος γίνεται ο δεσμός και τόσο ισχυρότερα κολλάνε τα άτομα μεταξύ τους.
Οι δεσμοί μπορούν επίσης να διαλυθούν. Δεδομένου ότι οι περισσότεροι δεσμοί απαιτούν ενέργεια για να σχηματιστούν, εκλύουν επίσης ενέργεια όταν διασπώνται. Αλλά πριν από τη διάσπαση των περισσότερων δεσμών, το μόριο πρέπει να θερμανθεί. Τότε τα άτομα αρχίζουν να κινούνται, και όταν κινούνται πολύ, ο δεσμός σπάει. Τα μόρια που απαιτούν λιγότερη ενέργεια για να σπάσουν απ' όση εκλύουν όταν σπάσουν ονομάζονται καύσιμα. Για παράδειγμα, ένα κερί απλά κάθεται εκεί και δεν συμβαίνει τίποτα. Όταν όμως χρησιμοποιήσετε ένα σπίρτο για να το ανάψετε, θα καίει για μεγάλο χρονικό διάστημα. Το σπίρτο φέρνει την ενέργεια για να σπάσουν οι πρώτοι δεσμοί, οι οποίοι απελευθερώνουν αρκετή ενέργεια για να σπάσουν οι δεσμοί κάτω από αυτούς, μέχρι το κερί να καεί.
Υπάρχουν επίσης ιοντικοί δεσμοί.
Ερωτήσεις και απαντήσεις
Q: Τι είναι ένα μόριο;
Α: Ένα μόριο είναι η μικρότερη δυνατή ποσότητα μιας χημικής ουσίας. Αποτελείται από άτομα συνδεδεμένα το ένα με το άλλο σε ένα συγκεκριμένο σχήμα ή μορφή.
Ερ: Πόσους δεσμούς έχουν τα άτομα οξυγόνου, άνθρακα και αζώτου;
Α: Τα άτομα οξυγόνου έχουν πάντα δύο δεσμούς με άλλα άτομα, τα άτομα άνθρακα έχουν πάντα τέσσερις δεσμούς με άλλα άτομα και τα άτομα αζώτου έχουν πάντα τρεις δεσμούς με άλλα άτομα.
Ερ: Τι λέει η κινητική θεωρία των αερίων για τα μόρια;
Α: Σύμφωνα με την κινητική θεωρία των αερίων, ο όρος μόριο χρησιμοποιείται συχνά για όλα τα αέρια σωματίδια, ανεξάρτητα από τη σύστασή τους. Αυτό σημαίνει ότι τα άτομα των ευγενών αερίων θεωρούνται μόρια επειδή είναι στην πραγματικότητα μονοατομικά μόρια.
Ερ: Πώς συμπεριφέρονται τα μόρια σε διαφορετικές καταστάσεις;
Α: Στα αέρια, όπως ο αέρας, τα μόρια απλά πετούν γύρω-γύρω. Στα υγρά, όπως το νερό, τα μόρια είναι κολλημένα μεταξύ τους, αλλά εξακολουθούν να κινούνται. Στα στερεά, όπως η ζάχαρη, τα μόρια μπορούν μόνο να δονούνται. Στο πλάσμα (την τέταρτη κατάσταση της ύλης), τα άτομα είναι ιονισμένα και δεν μπορούν να σχηματίσουν μόρια.
Ερ: Ποιος είναι ο μοριακός τύπος;
Α: Ο μοριακός τύπος χρησιμοποιείται για να γράψουμε τον αριθμό των ατόμων σε ένα μόριο. Για παράδειγμα, C6H12O6 σημαίνει ένα μόριο γλυκόζης, το οποίο αποτελείται από έξι άτομα άνθρακα, δώδεκα άτομα υδρογόνου και έξι άτομα οξυγόνου.
ψάχνω