Οι χηλετροπικές αντιδράσεις
Οι χηλετροπικές αντιδράσεις είναι ένας τύπος περισυλλεκτικής αντίδρασης όπου ένα άτομο σε ένα από τα αντιδραστήρια αποκτά δύο νέους δεσμούς. Μια περικυκλική αντίδραση είναι μια αντίδραση που περιλαμβάνει μια μεταβατική κατάσταση με μια κυκλική σειρά ατόμων και μια σχετική κυκλική σειρά αλληλεπιδρώντων τροχιακών. Σε αυτή την κυκλική συστοιχία λαμβάνει χώρα αναδιοργάνωση των δεσμών σ και π.
Οι χηλετροπικές αντιδράσεις είναι μια υποκατηγορία των κυκλοπροσθέσεων. Αυτό που διαφοροποιεί τις χηλετροπικές αντιδράσεις είναι ότι σε ένα από τα αντιδραστήρια, και οι δύο νέοι δεσμοί δημιουργούνται στο ίδιο άτομο. Μερικά παραδείγματα παρουσιάζονται δεξιά στο Σχήμα 1. Στην πρώτη περίπτωση, το μοναδικό άτομο είναι το άτομο άνθρακα της καρβονυλικής ομάδας. Αυτό το άτομο άνθρακα καταλήγει στο μονοξείδιο του άνθρακα. Το τελικό αποτέλεσμα είναι η δημιουργία δύο νέων δεσμών σε ένα άτομο. Τα δύο πρώτα παραδείγματα είναι γνωστά ως "χηλεκτρονικές εκχυλίσεις" επειδή ένα μικρό σταθερό μόριο αποδίδεται κατά την αντίδραση. Η κινητήρια δύναμη για αυτές τις αντιδράσεις είναι συχνά το εντροπικό όφελος από την απελευθέρωση ενός αερίου (π.χ. CO ή Ν2).

Σχήμα 1. Περικυκλικές αντιδράσεις
Θεωρητική ανάλυση
Λόγω της γεωμετρίας των μορίων που εμπλέκονται στις χηλετροπικές αντιδράσεις, επιβεβαιώνουν ορισμένες προβλέψεις που έχουν γίνει από θεωρητικούς χημικούς. Οι χηλετροπικές αντιδράσεις επιβεβαιώνουν τη διατήρηση της συμμετρίας των μοριακών τροχιακών.
Στην περικυκλική μεταβατική κατάσταση, ένα μικρό μόριο δίνει δύο ηλεκτρόνια στον δακτύλιο. Δύο πιθανές γεωμετρίες μπορούν να εξηγήσουν την αντίδραση. Το μικρό μόριο μπορεί να προσεγγίσει είτε με γραμμικό είτε με μη γραμμικό τρόπο. Στη γραμμική προσέγγιση, τα ηλεκτρόνια στο τροχιακό του μικρού μορίου είναι στραμμένα απευθείας προς το σύστημα π του μεγάλου μορίου. Στη μη γραμμική προσέγγιση, το τροχιακό πλησιάζει υπό ελαφρώς αποκλίνουσα γωνία. Η ικανότητα του συστήματος π να περιστρέφεται καθώς το μικρό μόριο πλησιάζει είναι ζωτικής σημασίας για το σχηματισμό νέων δεσμών. Η κατεύθυνση της περιστροφής θα είναι διαφορετική ανάλογα με το πόσα π-ηλεκτρόνια υπάρχουν στο σύστημα. Ένα διάγραμμα ενός θραύσματος δύο ηλεκτρονίων που πλησιάζει ένα π-σύστημα τεσσάρων ηλεκτρονίων με τη χρήση συνοριακών μοριακών τροχιακών φαίνεται παρακάτω. Η περιστροφή θα είναι διστροφική εάν το μικρό μόριο προσεγγίζει γραμμικά και περιστροφική εάν το μόριο προσεγγίζει μη γραμμικά. Οι αποπροσανατολιστικές και οι συγκρουσιακές δηλώνουν πώς περιστρέφονται οι δεσμοί στο π-σύστημα. Αποστροφικό σημαίνει αντίθετες κατευθύνσεις, ενώ περιστροφικό σημαίνει την ίδια κατεύθυνση. Αυτό φαίνεται και στο παρακάτω διάγραμμα.
Χρησιμοποιώντας τον κανόνα του Huckel, μπορεί κανείς να πει αν το π-σύστημα είναι αρωματικό ή αντι-αρωματικό. Εάν είναι αρωματικό, οι γραμμικές προσεγγίσεις χρησιμοποιούν διστροφική κίνηση, ενώ οι μη γραμμικές προσεγγίσεις χρησιμοποιούν κωνοειδής κίνηση. Το αντίθετο συμβαίνει με ένα αντι-αρωματικό σύστημα. Οι γραμμικές προσεγγίσεις θα έχουν περιστροφική κίνηση ενώ οι μη γραμμικές προσεγγίσεις θα έχουν αποστροφική κίνηση.
Χηλετροπικές αντιδράσεις με συμμετοχή SO2
Θερμοδυναμική
Όταν το διοξείδιο του θείου αντιδρά με το βουταδιένιο και το ισοπρένιο, προκύπτουν δύο διαφορετικά προϊόντα. Ο μηχανισμός της αντίδρασης θα ελέγξει τι θα παραχθεί. Ένα κινητικό προϊόν και ένα θερμοδυναμικό προϊόν είναι αμφότερα πιθανά. Το θερμοδυναμικό προϊόν παράγεται περισσότερο από το κινητικό προϊόν. Το κινητικό προϊόν προέρχεται από μια αντίδραση Diels-Alder, ενώ μια χηλετροπική αντίδραση παράγει ένα πιο θερμοδυναμικά σταθερό προϊόν. Το χηλετροπικό μονοπάτι χρησιμοποιείται περισσότερο, επειδή δημιουργεί ένα πιο σταθερό προσάρτημα πενταμελούς δακτυλίου. Το παρακάτω σχήμα δείχνει τη διαφορά μεταξύ των δύο προϊόντων. Το μονοπάτι στα αριστερά δείχνει το θερμοδυναμικό προϊόν, ενώ το μονοπάτι στα δεξιά δείχνει το κινητικό προϊόν. Οι Suarez και Sordo το έδειξαν αυτό το 1995. Το έδειξαν τόσο με πειράματα όσο και με υπολογισμούς του Gauss.
Κινητική
Ένα παράδειγμα είναι οι χηλετροπικές αντιδράσεις των 1,3-διενίων με διοξείδιο του θείου. Οι χημικοί έχουν εξετάσει προσεκτικά την κινητική αυτής της αντίδρασης. Το 1976, οι Isaacs και Laila μέτρησαν τους κενετικούς παράγοντες για την προσθήκη διοξειδίου του θείου σε παράγωγα βουταδιενίου. Οι ρυθμοί προσθήκης παρακολουθήθηκαν σε βενζόλιο στους 30 °C με αρχική εικοσαπλάσια περίσσεια διενίου. Χρησιμοποίησαν φασματοφωτόμετρο για τη μελέτη του φωτός στα 320 nm για να μετρήσουν την εξαφάνιση του SO2. Η αντίδραση έδειξε "κινητική ψευδοπρώτης τάξης". Οι χημικοί διαπίστωσαν ότι οι ομάδες που έλκουν ηλεκτρόνια από το διένιο μείωναν τον ρυθμό της αντίδρασης. Επίσης, ο ρυθμός της αντίδρασης επηρεάστηκε σημαντικά από τις στερικές επιδράσεις των 2-υποκαταστατών, με τις πιο ογκώδεις ομάδες να αυξάνουν τον ρυθμό της αντίδρασης. (Με άλλα λόγια, όσο μεγαλύτερη ήταν η ομάδα των ατόμων που κρέμονταν από το δεύτερο άτομο άνθρακα, τόσο πιο γρήγορα έτρεχε η αντίδραση). Οι συγγραφείς το αποδίδουν αυτό στην τάση των ογκωδών ομάδων να ευνοούν την cisoid διαμόρφωση του διενίου, η οποία είναι απαραίτητη για την αντίδραση (βλ. παρακάτω πίνακα). Επιπλέον, μετρήθηκαν οι ρυθμοί σε τέσσερις θερμοκρασίες για επτά από τα διένια. Από αυτές τις μετρήσεις, οι χημικοί χρησιμοποίησαν την εξίσωση Arrhenius για να υπολογίσουν την ενθαλπία ενεργοποίησης (ΔH‡) και την εντροπία ενεργοποίησης (ΔS‡) για κάθε αντίδραση. Αυτή ήταν μια από τις πρώτες σημαντικές προσπάθειες για τη μελέτη της κενοτικής μιας χηλετροπικής αντίδρασης.
| -Βουταδιένιο | 104 k /min−1 (30 °C) (± 1-2%) απόλυτο | 104 k /min−1 (30 °C) (± 1-2%) σχετικό | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K −1 |
| 2-μεθύλιο | 1.83 | 1.00 | 14.9 | -15 |
| 2-αιθυλένιο | 4.76 | 2.60 | 10.6 | -20 |
| 2-ισοπροπυλ | 13.0 | 7.38 | 12.5 | -17 |
| 2-τερτ-βουτύλιο | 38.2 | 20.8 | 10.0 | -19 |
| 2-νεοπεντύλιο | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-βρωμοαιθυλένιο | 0.72 | 0.39 | N/A | N/A |
| 2-π-τολύλιο | 24.7 | 13.5 | 10.4 | -19 |
| 2-φαινυλο | 17.3 | 9.45 | N/A | N/A |
| 2-(p-βρωμοφαινύλιο) | 9.07 | 4.96 | N/A | N/A |
| 2,3-διμεθυλο | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-μεθύλιο | 0.18 | 0.10 | N/A | N/A |
| τρανς-1-μεθύλιο | 0.69 | 0.38 | N/A | N/A |
| 1,2-διμεθυλένιο-κυκλοεξάνιο | 24.7 | 13.5 | 11.4 | -16 |
| 2-μεθυλ-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
Οι Monnat, Vogel και Sordo, το 2002, μέτρησαν την κινητική της προσθήκης διοξειδίου του θείου σε 1,2-διμεθυλιδενοκυκλοαλκάνια. Έγραψαν ότι η αντίδραση του 1,2-διμεθυλιδενοκυκλοεξανίου με διοξείδιο του θείου μπορεί να δώσει δύο διαφορετικά προϊόντα ανάλογα με τις συνθήκες αντίδρασης. Υπό κινητικό έλεγχο (≤ -60 °C) η αντίδραση παράγει την αντίστοιχη σουλφίνη μέσω μιας αντίδρασης ετερο-Diels-Alder, αλλά, υπό θερμοδυναμικό έλεγχο (≥ -40 °C), η αντίδραση παράγει το αντίστοιχο σουλφολένιο μέσω μιας χηλετροπικής αντίδρασης. Η ενθαλπία ενεργοποίησης για την αντίδραση hetero-Diels-Alder είναι περίπου 2 kcal/mol μικρότερη από εκείνη της αντίστοιχης χηλετροπικής αντίδρασης. Το σουλφολένιο είναι περίπου 10 kcal/mol πιο σταθερό από την ισομετρική σουλτίνη σε διάλυμα CHCl/SO. 222
Οι συγγραφείς μπόρεσαν να επεξεργαστούν πειραματικά έναν νόμο ταχύτητας στους 261,2 Κ για την αντίδραση του 1,2-διμεθυλιδενοκυκλοεξανίου με διοξείδιο του θείου προς το αντίστοιχο σουλφολένιο. Η αντίδραση ήταν πρώτης τάξης στο 1,2-διμεθυλιδενοκυκλοεξάνιο, αλλά δεύτερης τάξης στο διοξείδιο του θείου (βλέπε παρακάτω). Αυτό επιβεβαίωσε μια πρόβλεψη θεωρητικών χημικών που βασίστηκε σε υψηλού επιπέδου κβαντικούς υπολογισμούς ab initio. Χρησιμοποιώντας υπολογιστικές μεθόδους, οι συγγραφείς πρότειναν μια δομή μετάβασης για τη χηλετροπική αντίδραση του 1,2-διμεθυλιδενοκυκλοεξανίου με διοξείδιο του θείου (βλ. σχήμα δεξιά). Η αντίδραση είναι δεύτερης τάξης στο διοξείδιο του θείου, επειδή ένα άλλο μόριο διοξειδίου του θείου πιθανότατα δεσμεύεται στη μεταβατική κατάσταση για να συμβάλει στη σταθεροποίησή της. Παρόμοια αποτελέσματα βρέθηκαν σε μια μελέτη του 1995 από τους Suarez, Sordo και Sordo, οι οποίοι χρησιμοποίησαν υπολογισμούς ab initio για να μελετήσουν τον κινητικό και θερμοδυναμικό έλεγχο της αντίδρασης του διοξειδίου του θείου με 1,3-διένια.
d [ ]3 d t = k [2 ] 1[ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}}
Επιδράσεις του διαλύτη
Η επίδραση του διαλύτη της χηλετροπικής αντίδρασης του 3,4-διμεθυλο-2,5-διυδροθειοφαιν-1,1-διοξειδίου (απεικονίζεται στα δεξιά) διερευνήθηκε κινητικά σε 14 διαλύτες. Διαπιστώθηκε ότι οι σταθερές ταχύτητας της αντίδρασης της εμπρόσθιας και της αντίστροφης αντίδρασης, εκτός από τις σταθερές ισορροπίας, συσχετίζονται γραμμικά με την κλίμακα πολικότητας του διαλύτη ET(30).
Οι αντιδράσεις πραγματοποιήθηκαν στους 120 °C και μελετήθηκαν με φασματοσκοπία 1H-NMR του μίγματος αντίδρασης. Διαπιστώθηκε ότι ο ρυθμός προώθησης k1 μειώνεται κατά 4,5 φορές από το κυκλοεξάνιο στη μεθανόλη. Ο αντίστροφος ρυθμός k-1 βρέθηκε να αυξάνεται κατά 53 φορές από το κυκλοεξάνιο στη μεθανόλη, ενώ η σταθερά ισορροπίας K eqμειώθηκε κατά 140 φορές. Προτείνεται ότι υπάρχει αλλαγή της πολικότητας κατά τη διάρκεια της διαδικασίας ενεργοποίησης, όπως αποδεικνύεται από τις σχέσεις μεταξύ των δεδομένων ισορροπίας και των κινητικών δεδομένων. Οι συγγραφείς λένε ότι η αντίδραση φαίνεται να επηρεάζεται από την πολικότητα του διαλύτη και αυτό μπορεί να φανεί από την αλλαγή των διπολικών ροπών κατά τη μετάβαση από το αντιδρών στην κατάσταση μετάβασης στο προϊόν. Οι συγγραφείς αναφέρουν επίσης ότι η χηλετροπική αντίδραση δεν φαίνεται να επηρεάζεται ούτε από την οξύτητα ούτε από τη βασικότητα του διαλύτη.
Τα αποτελέσματα αυτής της μελέτης οδηγούν τους συγγραφείς να αναμένουν τις ακόλουθες συμπεριφορές:
1. Η αλλαγή στην πολικότητα του διαλύτη θα επηρεάσει τον ρυθμό λιγότερο από την ισορροπία.
2. Οι σταθερές ταχύτητας θα χαρακτηρίζονται από αντίθετη επίδραση στην πολικότητα: το k1 θα μειώνεται ελαφρώς με την αύξηση του ET(30) και το k-1 θα αυξάνεται υπό τις ίδιες συνθήκες.
3. Η επίδραση στο k-1 θα είναι μεγαλύτερη από ό,τι στο k1.

Αντίδραση του 1,2-διμεθυλιδενοκυκλοεξανίου με SO2 δίνει μια σουλτίνη μέσω μιας αντίδρασης Hetero-Diels-Alder υπό κινητικό έλεγχο ή ένα σουλφολένιο μέσω μιας χηλετροπικής αντίδρασης υπό θερμοδυναμικό έλεγχο

Προτεινόμενη μεταβατική κατάσταση για την αντίδραση του 1,2-διμεθυλιδενοκυκλοεξανίου με SO2 για την παραγωγή σουλφολενίου μέσω χηλετροπικής αντίδρασης
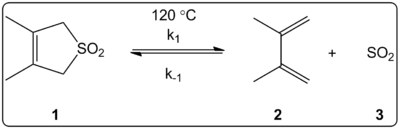
Μελέτη της χηλετροπικής αντίδρασης σε διάφορους διαλύτες
Προσθήκες καρβενίων σε αλκένια
Μια από τις πιο σημαντικές συνθετικά χηλετροπικές αντιδράσεις είναι η προσθήκη ενός μονήρους καρβένιου σε ένα αλκένιο για την παραγωγή ενός κυκλοπροπανίου (βλέπε σχήμα αριστερά). Ένα καρβένιο είναι ένα ουδέτερο μόριο που περιέχει ένα δισθενή άνθρακα με έξι ηλεκτρόνια στο κέλυφος σθένους του. Εξαιτίας αυτού, τα καρβένια είναι εξαιρετικά δραστικά ηλεκτρόφιλα και παράγονται ως ενδιάμεσα προϊόντα αντιδράσεων. Ένα μονήρες καρβένιο περιέχει ένα κενό τροχιακό p και ένα περίπου 2υβριδικό τροχιακό sp που έχει δύο ηλεκτρόνια. Τα μονήρη καρβένια προστίθενται στερεοειδώς στα αλκένια και η στερεοχημεία του αλκενίου διατηρείται στο προϊόν κυκλοπροπάνιο. Ο μηχανισμός για την προσθήκη ενός καρβενίου σε ένα αλκένιο είναι μια συντονισμένη [2+1] κυκλοπροσθήκη (βλέπε σχήμα). Καρβένια προερχόμενα από χλωροφόρμιο ή βρωμοφόρμιο μπορούν να χρησιμοποιηθούν για την προσθήκη CX2 σε αλκένιο για την παραγωγή διχαλοκυκλοπροπανίου, ενώ το αντιδραστήριο Simmons-Smith προσθέτει CH2.
Η αλληλεπίδραση του συμπληρωμένου τροχιακού καρβένιου με το σύστημα π του αλκενίου δημιουργεί ένα σύστημα τεσσάρων ηλεκτρονίων και ευνοεί μια μη γραμμική προσέγγιση. Είναι επίσης ευνοϊκή η ανάμειξη του κενού τροχιακού π του καρβένιου με το γεμάτο τροχιακό π του αλκενίου. Η ευνοϊκή ανάμειξη πραγματοποιείται μέσω μιας μη γραμμικής προσέγγισης (βλέπε σχήμα 2 στα δεξιά). Ωστόσο, ενώ η θεωρία ευνοεί σαφώς μια μη γραμμική προσέγγιση, δεν υπάρχουν προφανείς πειραματικές επιπτώσεις για μια γραμμική έναντι μιας μη γραμμικής προσέγγισης.

Προσθήκη ενός καρβένιου σε ένα αλκένιο για το σχηματισμό ενός κυκλοπροπανίου

Σχήμα 2. Α) Τα τροχιακά για τα μονήρη καρβένια Β) Μη γραμμική προσέγγιση του α) τροχιακού sp2 του καρβένιου και του β) τροχιακού p του καρβένιου
Ερωτήσεις και απαντήσεις
Ερ: Τι είναι η τσελετροπική αντίδραση;
A: Η χηλετροπική αντίδραση είναι ένας τύπος περισυλλεκτικής αντίδρασης όπου ένα άτομο σε ένα από τα αντιδραστήρια αποκτά δύο νέους δεσμούς.
Ερ: Τι είναι η περισυλλεκτική αντίδραση;
A: Περικυκλική αντίδραση είναι η αντίδραση που περιλαμβάνει μια μεταβατική κατάσταση με κυκλική διάταξη ατόμων και σχετική κυκλική διάταξη αλληλεπιδρώντων τροχιακών, στην οποία υπάρχει αναδιοργάνωση των δεσμών َ και ً.
Ερ: Σε τι διαφέρει από άλλους τύπους αντιδράσεων;
Α: Οι χηλετροπικές αντιδράσεις είναι μια υποκατηγορία των κυκλοπροσθέσεων και αυτό που τις διαφοροποιεί από τους άλλους τύπους αντιδράσεων είναι ότι σε ένα από τα αντιδραστήρια, και οι δύο νέοι δεσμοί δημιουργούνται στο ίδιο άτομο.
Ερ: Ποια είναι μερικά παραδείγματα;
Α: Στα παραδείγματα περιλαμβάνονται οι "χηλετροπικές εξαλλαγές", όπως όταν το μοναδικό άτομο της καρβονυλικής ομάδας καταλήγει σε μονοξείδιο του άνθρακα.
Ερ: Τι κινεί αυτές τις αντιδράσεις;
Α: Η κινητήρια δύναμη για αυτές τις αντιδράσεις είναι συχνά το εντροπικό όφελος από την απελευθέρωση ενός αερίου (π.χ. CO ή N2).
Ερ: Το σχήμα 1 σχετίζεται με τις χηλετροπικές αντιδράσεις; Α: Ναι, το Σχήμα 1 παρουσιάζει παραδείγματα χηλετροπικών αντιδράσεων.
ψάχνω
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)